Chémia je predmet, ktorý sa študuje na strednej škole a neskôr aj na univerzite ako súčasť ďalšieho vzdelávania.
Niektorí si chceli rozšíriť vedomosti, pretože ich zaujali základné chemické pojmy a chceli o tejto vede vedieť viac. Iní sa k učivu o chémii dostali preto, že ju museli študovať v posledných ročníkoch strednej školy.
Chémia môže byť dobrá aj zlá. Je dobrá, keď ju využijete na lásku. Je zlá, keď ju využijete na výrobu drog.
– Adam Sandler
Úprimne, chémia nie je pre každého. Niektorí si ju obľúbia, iným vôbec nesadne. Zahŕňa štúdium prvkov, zlúčenín, atómov, molekúl či iónov – teda všetkého, z čoho sa skladá svet okolo nás. Pre niekoho je to fascinujúce, pre iného zas úplne nezrozumiteľné.
Napriek tomu má štúdium základných chemických pojmov veľa výhod. Chémia sa považuje za centrálnu vedu, pretože prepája matematiku, fyziku, biológiu aj medicínu. Je to rozsiahla disciplína s množstvom zaujímavých oblastí, ktoré môžu zaujať každého nadšenca vedy.
Viac o kľúčových pojmoch sa dozviete v našom samostatnom článku, kde vysvetľujeme dôležité chemické termíny zrozumiteľne a ľudsky.

Chemické reakcie

Superprof vám teraz predstaví niekoľko základných pojmov z chémie – napríklad chemické reakcie, chemické prvky, Lewisovu štruktúru, periodickú tabuľku chemických prvkov či skupenstvá látok.
Nezáleží na tom, či vedu milujete, alebo nie – tento článok vám pomôže porozumieť základom chémie a získať prehľad, ktorý využijete napríklad aj v bežnej konverzácii.
Chémia skúma látky a ich premeny. Pomáha nám pochopiť, ako fungujú živé organizmy, materiály, lieky či priemyselné procesy. Je kľúčová pre medicínu, potravinárstvo, energetiku aj ochranu životného prostredia.
Molekulárne zmeny, ku ktorým dochádza pri chemickej reakcii, voľným okom nevidíme. Napriek tomu existujú znaky, podľa ktorých ju vieme rozoznať – napríklad zmena teploty, vznik bubliniek alebo zmena farby.
Atómy a molekuly, ktoré medzi sebou reagujú, nazývame reaktanty. Tie, ktoré pri reakcii vzniknú, označujeme ako produkty. Zjednodušene by chemická rovnica mohla vyzerať takto:
reaktant1 + reaktant2 + ... → produkt1 + produkt2 + ...
Tí, ktorí študovali chémiu a majú základy chemických reakcií, dokážu rovnicu zapísať v skrátenej verzii:
𝒂 𝐀
+ 𝒃 𝐁 + ... -----> 𝒄 𝐂 + 𝒅 𝐃 + ...
Chemické reakcie možno rozdeliť do štyroch základných typov:
- Syntéza alebo priama kombinácia,
- Rozklad,
- Jednoduchá zámenná reakcia,
- Metatéza, známa aj ako dvojitá zámenná reakcia.
V priebehu dňa či týždňa sa bežne stretávame s rôznymi chemickými reakciami – mnohé z nich si ani neuvedomujeme. Medzi najznámejšie príklady patria:
- Zapálenie ohňa alebo plameňa,
- Pečenie koláča či iného pečiva,
- Varenie, vyprážanie alebo miešanie vajíčka,
- Hnijúci banán,
- Grilovanie hamburgerovej placky.
A to je len začiatok. Svet základných chemických pojmov a reakcií je oveľa širší a ponúka množstvo fascinujúcich informácií na objavovanie.
Chemické prvky a periodická tabuľka
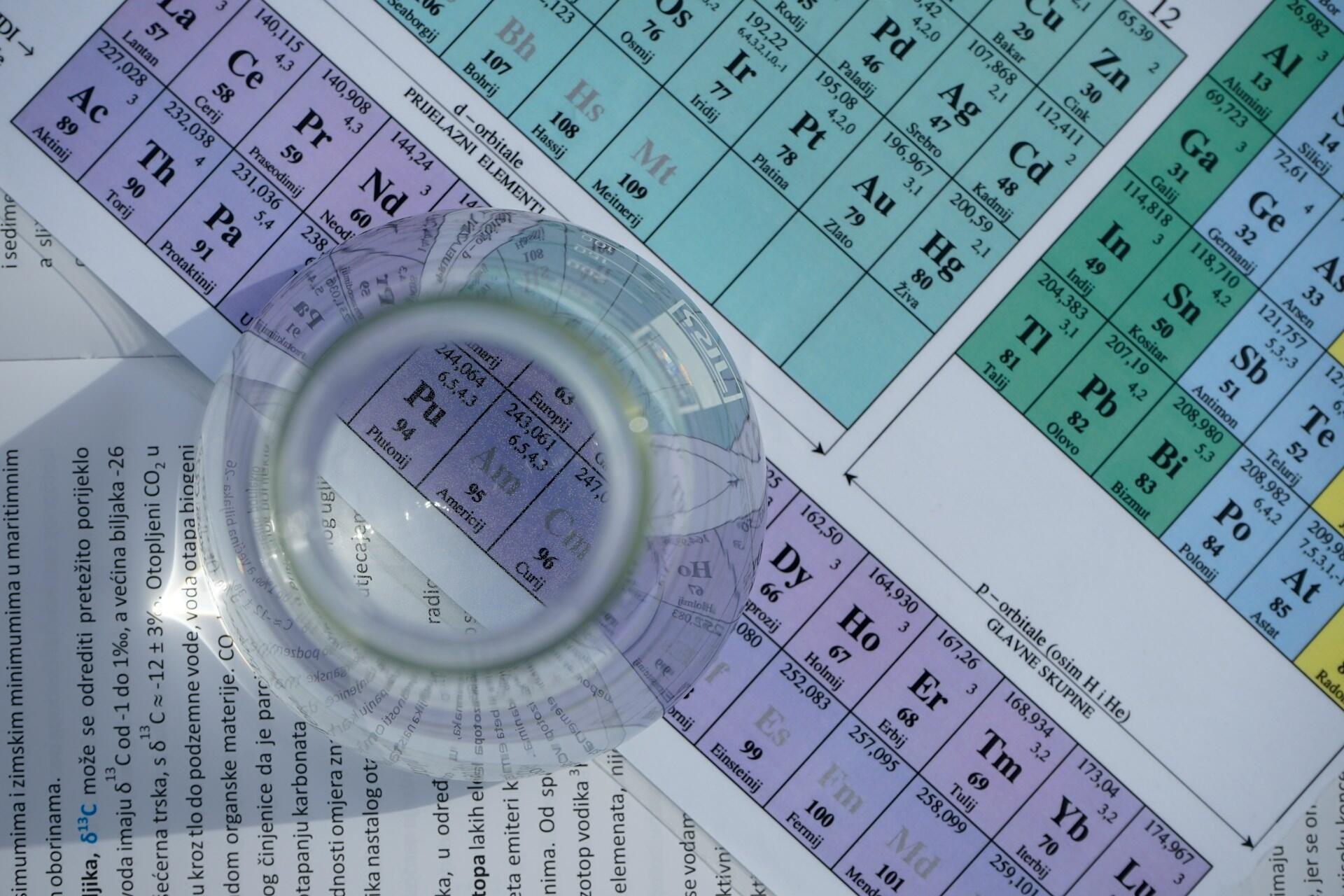
Chemický prvok je čistá látka v jej najjednoduchšej forme, ktorú nemožno ďalej rozkladať.
Doteraz vedci objavili 118 chemických prvkov. Z toho 94 prvkov sa prirodzene vyskytuje v prírode, zatiaľ čo zvyšných 24 je syntetických – teda človekom vytvorených.
Najhojnejším chemickým prvkom vo vesmíre je vodík, zatiaľ čo na Zemi je to železo. V ľudskom tele aj na Zemi je najrozšírenejším prvkom kyslík.
Chemický prvok je látka tvorená jediným typom atómu a jeho hlavným znakom je počet protónov v jadre atómu. Tento počet sa nazýva atómové číslo a označuje sa písmenom Z.
Prvky v ich čistej forme obsahujú atómy s rovnakým počtom protónov. Zmesi naopak pozostávajú z rôznych atómov a protónov, preto nie sú chemicky čisté.
Úplne čistých chemických prvkov, ktoré sa v prírode nachádzajú bez kombinácie s inými látkami, je len niekoľko. Patrí medzi ne napríklad meď, striebro, zlato či síra. Na druhej strane máme aj príklady zmesí, kde sú prvky navzájom premiešané. Typickým príkladom je atmosférický vzduch, ktorý obsahuje dusík, kyslík a argón.
Príklady rôznych chemických prvkov nájdete priamo v periodickej tabuľke prvkov. Prvým prvkom je vodík, ktorý má len jeden protón. Nasleduje hélium s dvoma protónmi a tretím je lítium s tromi protónmi.
Počet protónov sa v tabuľke postupne zvyšuje, až sa dostaneme k prvku číslo 118, ktorým je oganessón – jeden z najnovšie objavených prvkov.
O ďalších významných objavoch v chémii si môžete prečítať v našom článku.
Chemické prvky sú zoradené podľa ich protónového čísla, elektrónovej konfigurácie a podobných vlastností. Vodorovné riadky nazývame periódy, zvislé stĺpce skupiny. Tento systém pomáha pochopiť správanie prvkov a ich vzťahy.
Periodická tabuľka prvkov obsahuje 18 skupín (teda zvislých stĺpcov), ktoré sú usporiadané tak, aby sa prvky s podobnými chemickými vlastnosťami nachádzali na rovnakom mieste. Z týchto skupín má len sedem oficiálne názvy:
- Skupina 1: alkalické kovy
- Skupina 2: kovy alkalických zemín
- Skupina 15: pnikogény
- Skupina 16: chalkogény
- Skupina 17: halogény
- Skupina 18: vzácne plyny
Farby pozadia jednotlivých prvkov v tabuľke často vyjadrujú, či ide o kov, polokov alebo nekov. Neexistuje však jednotný farebný štandard – vzhľad tabuľky sa môže líšiť podľa toho, kto ju vytvára. Kategórie prvkov ale zostávajú rovnaké.
Základné poznatky o periodickej tabuľke chemických prvkov sú veľmi užitočné – pomáhajú pochopiť, ako sa rôzne prvky správajú a kde sa využívajú.
Chemické väzby a Lewisova štruktúra

Chemická väzba predstavuje príťažlivosť medzi atómami, iónmi a molekulami, ktorá umožňuje vznik chemických zlúčenín. Tieto väzby môžu mať rôznu silu – medzi najsilnejšie patria kovalentné, iónové a kovové väzby. Naopak, medzi slabšie interakcie radíme dipól-dipólové interakcie, Londonove disperzné sily a vodíkové väzby.
Niektoré väzby medzi atómami sú silné a trvalé, iné sa môžu ľahko rozpadnúť. Bez ohľadu na ich silu sú všetky dôležité – vďaka nim držia pohromade molekuly, ktoré tvoria naše telo aj celý svet okolo nás.
Vedci a chemici zistili, že hlavným dôvodom, prečo medzi atómami vznikajú chemické väzby, je ich snaha dosiahnuť čo najstabilnejšiu energetickú hladinu.
V chémii – rovnako ako v živote – sa protiklady priťahujú. Práve príťažlivosť medzi zápornými elektrónmi, ktoré obiehajú okolo jadra, a kladnými protónmi v jadre, spôsobuje silu, ktorá vedie k vytvoreniu chemickej väzby.
Existuje viacero typov chemických väzieb, ktoré sa dajú pozorovať v prírode aj v laboratóriu:
- Iónové väzby – vznikajú medzi iónmi s opačnými nábojmi. Typickým príkladom je kuchynská soľ. Kladne nabité sodíkové ióny a záporne nabité chlórové ióny sa pritiahnu a vytvoria chlorid sodný.
- Kovalentné väzby – atómy sa stanú stabilnejšími zdieľaním elektrónov namiesto ich straty alebo získania. Kovalentné väzby sú v molekulách živých organizmov oveľa bežnejšie než iónové. Čím viac elektrónov atómy zdieľajú, tým silnejšia je ich väzba.
- Polárne kovalentné väzby – elektróny nie sú medzi atómami rozdelené rovnomerne, ale trávia viac času pri jednom z nich. Výsledkom je, že v rôznych častiach molekuly vznikajú čiastočné náboje.
- Nepolárne kovalentné väzby – vznikajú medzi dvoma rovnakými atómami alebo atómami rôznych prvkov, ktoré si elektróny delia rovnomerne.
- Vodíkové väzby – vznikajú pri polárnych kovalentných väzbách, ktoré obsahujú vodík. Keďže elektróny sú priťahované k druhému prvku, vodík získa čiastočný kladný náboj a je priťahovaný k záporne nabitým časticiam. Tento jav sa nazýva vodíková väzba.

Lewisova štruktúra
Lewisova štruktúra (alebo Lewisov elektronový vzorec) znázorňuje väzby medzi atómami v molekule a tiež voľné páry elektrónov, ktoré sa môžu v molekule nachádzať.
Tento spôsob zápisu predstavil v roku 1916 Gilbert N. Lewis vo svojom článku s názvom The Atom and the Molecule. Rozvinul tak pôvodnú myšlienku elektronového diagramu tým, že k bodom pridal aj čiary – tie predstavujú zdieľané páry elektrónov v chemickej väzbe.
Ide o rýchly a jednoduchý spôsob, ako znázorniť valenčné elektróny jednotlivých atómov, ak ešte medzi nimi neexistujú žiadne väzby. Lewisova štruktúra pomáha pochopiť, ako atómy vytvárajú väzby a ako sa správa molekula ako celok.
Kyslosť a zásaditosť
Látky môžeme rozdeliť na kyseliny a zásady. Reakcia medzi týmito dvoma látkami sa nazýva acidobázická reakcia a patrí medzi bežné chemické reakcie. Pomocou nej možno zistiť napríklad pH látky alebo kvapaliny.
Rôzni vedci vytvorili vlastné teórie kyselín a zásad, ktoré sa používajú na výpočet pH hodnôt, presné určenie látok a pozorovanie ich správania pri reakciách.
Aj keď môže téma kyslosti a zásaditosti pôsobiť zložito, so správnym vedením – napríklad pod dohľadom skúseného učiteľa chémie – ju zvládnete bez problémov.
Lewisova teória kyselín a zásad podľa Gilberta Newtona Lewisa
Táto teória patrí medzi najmenej prísne výklady kyselín a zásad, pretože sa nezameriava na protóny – ako iné teórie – ale výhradne na elektrónové páry.
Základné princípy tejto teórie hovoria, že:
- kyseliny sú prijímateľmi elektrónových párov,
- zásady sú darcami elektrónových párov.
Lewisova teória rozšírila chápanie acidobázických reakcií aj na prípady, ktoré nezahŕňajú vodíkové ióny, a preto je veľmi užitočná pri analýze zložitejších chemických väzieb a procesov.
Brønsted-Lowryho teória kyselín a zásad
Podľa tejto teórie sa acidobázické reakcie opisujú ako proces, pri ktorom kyselina odovzdáva protón (vodíkový ión) a zásada protón prijíma. Medzi hlavné znaky tejto teórie patrí:
- kyseliny sú donory protónov,
- zásady sú akceptory protónov,
- sú akceptované vodné roztoky,
- uznáva zásady aj mimo hydroxidov,
- akceptované sú iba protické kyseliny (t. j. kyseliny, ktoré obsahujú vodíkový ión, ktorý môžu odovzdať).
Vlastnosti kyselín a zásad
Kyseliny sa dajú rozoznať podľa niekoľkých znakov. Majú typickú kyslú chuť, môžu mať korozívne účinky, ich vodné roztoky vedú elektrický prúd a reagujú so zásadami za vzniku solí a vody. Toto sú len niektoré z ich vlastností – existujú aj iné spôsoby, ako kyseliny identifikovať.
Zásady sa od kyselín odlišujú tým, že majú horkú chuť, na dotyk pôsobia klzko alebo mydlovo a nemenia farbu lakmusového papierika (ten je rastlinného pôvodu a modrej farby).
Na zisťovanie vlastností kyselín a zásad sa používajú rôzne chemické pomôcky a vybavenie, o ktorom sa môžete fočítať v našom článku.
Bežné typy kyselín, s ktorými sa stretávame:
- kyselina citrónová,
- kyselina mliečna,
- ocot (kyselina octová),
- kyselina uhličitá,
- kyselina askorbová (vitamín C).
Najčastejšie zásady v bežnom živote:
- pracie prostriedky,
- mydlá,
- lúh,
- čpavok (amoniak) v domácnosti.
Kyseliny a zásady sa dajú študovať aj podrobnejšie, najmä ak sa chcete oboznámiť s rôznymi teóriami ich správania a reakcií.
Chémia ako veda je veľmi rôznorodá a fascinujúca oblasť. Ak vás táto téma zaujala, vedzte, že základné chemické princípy môžete pochopiť aj sami doma. A ak sa rozhodujete, ktorou vedou sa zaoberať, chémia je určite správnou voľbou!
Ak túžite po ďalších informáciách, môžete si prečítať aj o významných chemických objavoch, zaujímavých faktoch z chémie alebo sa dozvedieť viac o najdôležitejších chemických pomôckach so Superprof. Ak hľadáte podporu pri učení chémie, pozrite si napríklad ponuku našich učiteľov pre doučovanie chémie v Bratislave.
Zhrnúť pomocou AI:















